Número: 7.7 - 6 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos Originais
Prevalência de Micro-Organismos Isolados em Amostras de Hemoculturas de Pacientes de Um Hospital Privado De Juiz de Fora - Mg
Prevalence of Microorganisms Isolated in Blood Cultures Samples from Patients from a Private Hospital in Juiz de Fora, Minas Gerais
Mayara Silveira Leal1, Patrícia Ganimi Tavella1, Patrícia Guedes Garcia2
1. Estudante do Programa de Pós - Graduação em Análises Clínicas da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora - SUPREMA
2. Doutora, Professora da Faculdade de Ciências Médicas e da Saúde de Juiz de Fora - SUPREMA
Email: [email protected]
Resumo
OBJETIVOS: Avaliar a prevalência de micro-organismos isolados de amostras de hemoculturas provenientes das Unidades de Terapia Intensiva; Definir o perfil de suscetibilidade aos antimicrobianos das cepas bacterianas isoladas.
MÉTODOS: Foram coletados dados de todas as hemoculturas positivas das UTI's Adulto, Neonatal e UC de um hospital privado, em Juiz de Fora, Minas Gerais, Brasil, de janeiro de 2017 a janeiro de 2019.
RESULTADOS: Foram encontradas 3536 amostras de hemoculturas onde 2464 (69,68%) foram negativas e 1072 (30,32%) positivas para algum micro-organismo. Dentre as amostras positivas, observou-se prevalência entre o sexo masculino (540/50,4%). Os microrganismos prevalentes foram: Staphylococus sp coagulase negativa (55,5%), Klebsiella pneumoniae (7,2%), Staphylococus aureus (5,4%), Serratia marcescens (4,7%), Escherichia coli (3,9%), Acinetobacter baumannii (3,6%), Pseudomonas aeruginosa (2,4%), Bastonetes Gram positivos (2,4%), Candida parapsilosis (2,2%), Enterobacter cloacae (2,0%), Enterococcus faecalis (1,4%) e Candida albicans (1,3%). Dentre as bactérias Gram positivas, a eritromicina, juntamente com a oxacilina, clindamicina e as quinolonas, foram os antimicrobianos que apresentaram maior grau de resistência. Já entre os Gram negativos, as cefalosporinas e quinolonas foram as drogas menos efetivas, apesar de os carbapenêmicos terem apresentado uma resistência importante.
CONCLUSÃO: o presente estudo alerta para o elevado grau de multirresistência aos antimicrobianos das cepas advindas das UTI's e UC, e ao crescente desenvolvimento de espécies coagulase negativas em hemoculturas, demonstrando um cenário atual preocupante e a necessidade de desenvolvimento de novas drogas e novas medidas de controle.
Palavras-chave: Sepse; Farmacorresistência Bacteriana; Testes de Sensibilidade a Antimicrobianos por Disco-Difusão.
INTRODUÇÃO
As infecções da corrente sanguínea (ICS) estão relacionadas a desfechos desfavoráveis em saúde. No Brasil, através do estudo Brazilian SCOOPE, foi observado cerca de 40% de mortalidade entre pacientes com ICS 1. A presença de bactérias ou fungos na corrente sanguínea é chamada de bacteremia e fungemia, respectivamente2. Dispositivos intravasculares, trato geniturinário, trato respiratório, intestino, trato biliar, abcesso intra-abdominal e sítios desconhecidos são as fontes mais comuns de ICS 3,4.
A resposta do organismo frente ao agente infeccioso se dá por meio de sinais e sintomas da doença, como a síndrome da resposta inflamatória sistêmica, independente da positividade ou não da hemocultura. A esse conjunto de respostas, dá-se o nome de sepse. Esta, por sua vez, promove uma disfunção orgânica e coloca em risco a vida do paciente. Apesar da precariedade de estudos de incidência e prevalência relacionados à sepse no Brasil, sabe-se que essa síndrome é considerada um grande problema de saúde pública em unidades de terapia intensiva (UTI's), gerando altos custos para os sistemas de saúde 3,5,6.
O exame de hemocultura é padrão-ouro para a detecção de micro-organismos no sangue. Este possui alto valor preditivo de infecção, uma vez que é possível detectar a presença de micro-organismos viáveis na corrente sanguínea. Sua positividade é um relevante indicador de ICS, e a identificação do patógeno causador é de suma importância, uma vez que auxilia na escolha terapêutica 3,5. Portanto, regimes terapêuticos inadequados induzem uma pressão seletiva, o que resulta no aumento de cepas resistentes, elevação dos custos de hospitalização e maiores taxas de mortalidade, especialmente em pacientes críticos 6, 7, 8,9.
Perante o exposto, o objetivo do presente estudo foi avaliar a prevalência de micro-organismos isolados em amostras de hemoculturas de pacientes das UTI's e Unidade Coronariana (UC) de um hospital privado da cidade de Juiz de Fora - MG e avaliar o perfil de suscetibilidade aos antimicrobianos das cepas bacterianas isoladas, contribuindo assim com pesquisas na área de prevenção das ICS, além do incentivo ao Uso Racional de Medicamentos.
MÉTODOS
O presente estudo é de natureza descritiva, do tipo retrospectivo transversal e teve por objetivo analisar amostras de hemoculturas realizadas no laboratório de análises clínicas de um hospital privado localizado na cidade de Juiz de Fora - MG, no período de janeiro de 2017 a janeiro de 2019.
Como critério de inclusão considerou-se todas as amostras de hemoculturas positivas. Os dados que fazem parte da pesquisa foram obtidos através dos arquivos digitais do software laboratorial Shift Lis® utilizado pelo Laboratório. Por se tratar de uma análise estatística de dados de exames já realizados, esta pesquisa representa riscos mínimos aos pacientes, porém significativos em relação à manipulação dos dados digitais.
Esse estudo foi previamente aprovado pelo Comitê de Ética Institucional de acordo com a resolução 196/96 Conselho Nacional de Saúde sob o parecer número 3.735.713.
As hemoculturas incluídas foram detectadas de forma automatizada pelo aparelho BACT/ALERT® 3D 60 da empresa BioMérieux, com posterior identificação e antibiograma no sistema Vitek® 2 Compact da BioMérieux com os cartões de identificação GN para Gram negativos fermentadores e não fermentadores com cartões de antibiograma AST-N238 e AST-N239, GP para Gram positivos e seu cartão de antibiograma complementar AST-P585, além do YST para identificação de leveduras.10
RESULTADOS
Foram coletadas 3536 amostras de hemoculturas provenientes das UTI's e UC no período de dois anos, sendo 2590 (73,3%) da UTI Adulto, 540 (15,3%) da UTI Neonatal e 406 (11,5%) da UC. Do total de amostras coletadas, 1072 (30,3%) apresentaram crescimento positivo e contemplaram o presente estudo.
Conforme a Tabela 1, dentre as amostras analisadas, 540 (50,4%) foram de pacientes do sexo masculino, enquanto 532 (49,6%) eram do sexo feminino. Observou-se também que mais de 80% dos pacientes possuíam 60 anos ou mais.
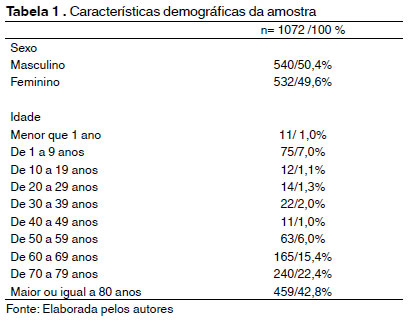
Na UTI Adulto, 865 amostras positivaram, as quais correspondem a 80,7% do total de amostras analisadas. O restante das amostras foi proveniente da UC (113/10,5%) e UTI Neonatal (94/8,8%).
Das 1072 amostras estudadas, 44 apresentaram crescimento concomitante de dois micro-organismos, totalizando 1116 micro-organismos isolados. Destes, 704 (63,1%) eram cocos Gram positivos, 327 (29,3%) foram classificados morfotintorialmente como bastonetes Gram negativos, 58 (5,2%) apresentaram-se como formas fúngicas e 27 (2,4%) como bastonetes Gram positivos.
De acordo com a tabela 2, os micro-organismos prevalentes foram: Staphylococus sp.coagulase negativa (55,5%), Klebsiella pneumoniae (7,2%), Staphylococus aureus (5,4%), Serratia marcescens (4,7%), Escherichia coli (3,9%), Acinetobacter baumannii (3,6%), Pseudomonas aeruginosa (2,4%), Bastonetes Gram positivos (2,4%), Candida parapsilosis (2,2%), Enterobacter cloacae (2,0%), Enterococcus faecalis (1,4%) e Candida albicans (1,3%).
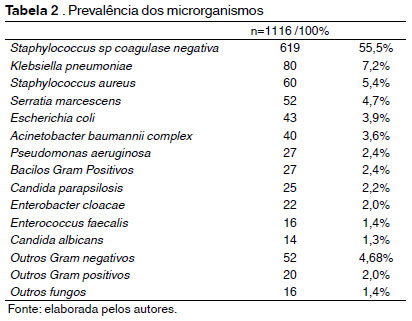
Os isolados pertencentes ao gênero Staphylococcus sp.foram os prevalentes (666/59,7%), seguidos pela ordem Enterobacteriales (237/21,2%), bastonetes Gram negativos não fermentadores (78/7,0%), fungos (57/5,1%), bacilos Gram positivos (27/2,4%) e cocos Gram positivos do gênero Enterococcus sp. (19/1,7%) conforme descrito na Tabela 2.
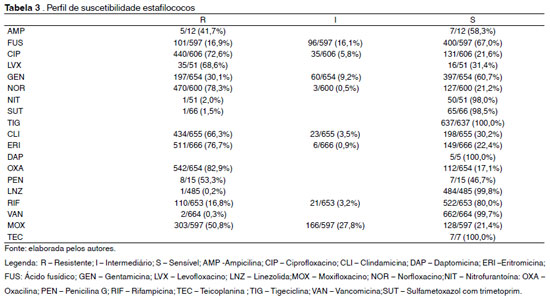
Dentre os estafilococos, na Tabela 3 temos o perfil de sensibilidade dos mesmos, onde a maior resistência encontrada foi à oxacilina (82,9%), seguida da eritromicina (76,7%). Quanto às quinolonas, 78,3% dos estafilococos foram resistentes ao norfloxacino, 72,6% ao ciprofloxacino, 68,6% ao levofloxacino e 50,8% ao moxifloxacino.
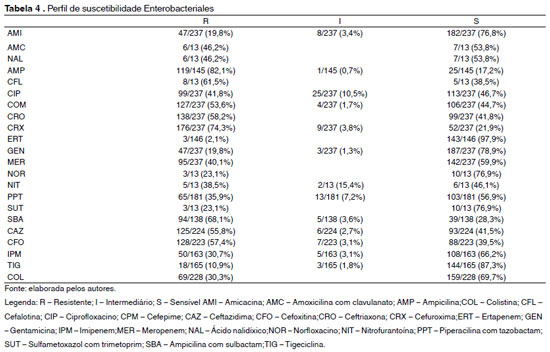
No teste de susceptibilidade aos antimicrobianos, os micro-organismos pertencentes à ordem Enterobacteriales apresentaram um alto índice de resistência. Dentre as cefalosporinas, 74,3% apresentaram resistência à cefuroxima, 61,5% à cefalotina, 58,2% à ceftriaxona, 55,8% à ceftazidima e 53,6% ao cefepime. Em relação às quinolonas, 46,2% das enterobactérias apresentaram resistência ao ácido nalidíxico, 41,8% ao ciprofloxacino e 23,1% ao norfloxacino; 82,1% das cepas mostraram-se resistentes à ampicilina e 68,1% à ampicilina com sulbactam; 23,1% foram resistentes à sulfametoxazol com trimetoprim; 19,8% das enterobactérias foram resistentes a amicacina e gentamicina. Foi observado também uma elevada resistência dessas enterobactérias aos carbapenêmicos, onde 40,1% foram resistentes ao meropenem, 30,7% ao imipenem e 2,1% ao ertapenem. Por fim, 57,4% apresentaram resistência à cefoxitina, 38,5% à nitrofurantoína, 35,9% à piperacilina com tazobactam, 30,3% à colistina e 10,9% à tigeciclina. Tais dados foram descritos na Tabela 4.
Das 237 enterobactérias isoladas, 14,4% (34/237) apresentaram mecanismo de resistência do tipo beta lactamase de espectro estendido (ESBL). Dessas, 73,5% (25/34) eram K.pneumoniae e 26,5% (9/34) E.coli.
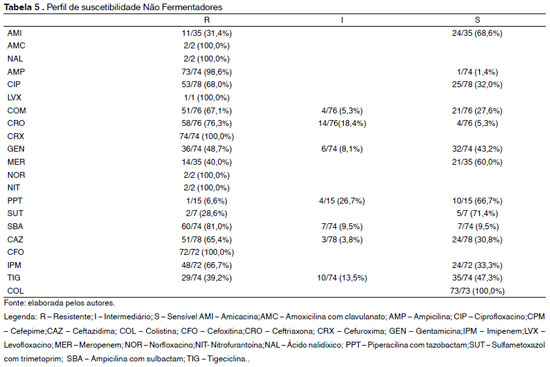
Na análise do perfil de suscetibilidade aos antimicrobianos dos bastonetes Gram negativos não fermentadores foi observada uma elevada porcentagem de resistência. Dentre as cefalosporinas, 100% das cepas analisadas foram resistentes à cefuroxima, 76,3% à ceftriaxona, 67,1% ao cefepime e 65,4% à ceftazidima. Quanto às quinolonas, 100% dos não fermentadores foram resistentes ao ácido nalidíxico, levofloxacino e norfloxacino, enquanto 68% mostraram-se resistentes ao ciprofloxacino. Em relação aos aminoglicosídeos, 48,7% das bactérias apresentaram resistência à gentamicina e 31,4% à amicacina. Já dentre os carbapenêmicos, 66,7% foram resistentes ao imipenem e 40% ao meropenem. 100% das cepas foram resistentes à nitrofurantoína, cefoxitina e amoxicilina com ácido clavulânico. A resistência desses não fermentadores se estende à tigeciclina e a piperacilina com tazobactam com 39,2% e 6,6% de resistência, respectivamente, conforme a Tabela 5.
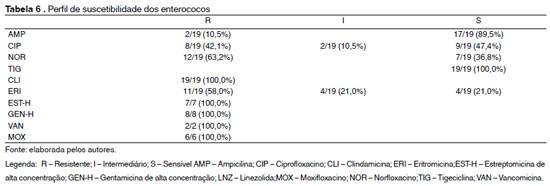
Dentre as 19 cepas de enterococos isoladas, 100% apresentaram resistência à clindamicina, à estreptomicina e gentamicina de alta concentração. Dentre as quinolonas, observou-se que 100% das bactérias foram resistentes ao moxifloxacino, 63,2% ao norfloxacino e 42,1% ao ciprofloxacino. Além desses antimicrobianos algumas cepas também foram testadas para vancomicina e para ampicilina, sendo que 100% delas mostram-se resistentes à vancomicina e 10,5% à ampicilina, como descrito na Tabela 6.
DISCUSSÃO
Em um estudo realizado por Rodriguéz et al. (2011) foram analisadas 1045 hemoculturas de interesse clínico, das quais 375 (35%) apresentaram-se positivas para algum patógeno e 670 (65%) foram negativas. Segundo Chen et al. (2015) e Weiss et al. (2016), a proporcionalidade de positividade das hemoculturas se mantém, onde a taxa de positividade varia entre 10% e 30%. Com isso, é possível afirmar que os resultados obtidos no presente estudo foram compatíveis: Do total de 3536 amostras de hemoculturas, 2464 (69,7%) tiveram resultado negativo, enquanto que 1072 (30,3%) positivaram para o crescimento de algum micro-organismo.
A presente pesquisa, evidenciou que as hemoculturas positivas analisadas foi de maior incidência no sexo masculino 540 (50,7%) em relação ao sexo feminino 532 (49,3%). Corroborando com esse resultado, está o estudo realizado por Sousa et al (2014) no qual foram avaliados resultados de exames de 170 hemoculturas positivas de pacientes hospitalizados em UTI, onde cerca de 56,0% eram do sexo masculino e 43,0%do sexo feminino. Isso se deve, de acordo com Couto et al (2011), provavelmente, pelo fato de os hormônios femininos, principalmente o estrogênio, promoverem uma melhor resposta imunológica às mulheres. Além disso, Wang et al. (2015) mostrou que cerca de 60,0% das sepses graves ocorreram em pacientes com mais de 60 anos, chamando atenção para a alta porcentagem de idosos com hemoculturas positivas encontrada nesse estudo.
De acordo com Morello et al. (2019) e Takeshita et al. (2019) estafilococos coagulase negativa foram os patógenos mais comumente isolados, e a elevada prevalência destes pode ser confirmada ao logo do estudo, com o isolamento de 619 espécies, representando 55,46% do total de patógenos isolados das hemoculturas. Segundo Park et al. (2015), estafilococos coagulase negativa são responsáveis por 20 a 30% das infecções em pacientes graves e geralmente estão associados a cateteres centrais e dispositivos implantáveis. A elevada prevalência desses micro-organismos indica uma possível contaminação na hora da coleta, uma vez que esse patógeno pode ser encontrado em vários sítios do corpo, incluindo a composição da microbiota da pele. No entanto, devido à natureza retrospectiva desse estudo, não foi possível avaliar se a detecção deste patógeno foi decorrente de uma infecção ou contaminação das amostras.
Quanto ao perfil de suscetibilidade a antimicrobianos, um estudo realizado por Ruschel et al. (2017) constatou elevada resistência de estafilococos à oxacilina, eritromicina, clindamicina e quinolonas, corroborando com a pesquisa.
Os principais bacilos Gram negativos encontrados no presente estudo foram Klebsiella pneumoniae, Serratia marcescens, Escherichia coli e Enterobacter cloacae. Essa prevalência foi semelhante à reportada por Basso et al.(2016), Mota et al.(2018) e Uc- Cachónet al (2019), onde entre os principais agentes patogênicos classificados como bacilos Gram negativos estavam Klebsiella pneumoniae e Escherichia coli.
A elevada taxa de resistência das enterobacterias às cefalosporinas, quinolononas, aminoglicosideos e carbapenêmicos descritas neste estudo são semelhantes à reportada em um estudo realizado em um hospital escola por Parajuli et al. (2017) e de acordo com Uc- Cachón et al. (2019), a elevada taxa de resistência às cefalosporinas se confirma.
Quanto à produção de ESBL, o estudo apresentou uma baixa porcentagem (14,4%), diferindo do estudo de Myat et al. (2017), que encontrou cerca de 38%. No entanto, ambos os estudos encontraram uma prevalência de Klebsiella pneumoniae dentre as cepas produtoras de beta lactamase de espectro estendido, seguido de Escherichia coli.
A prevalência encontrada de bastonetes Gram negativos não fermentadores, foi de Acinetobacter baumannii e Pseudomonas aeruginosa, o mesmo que foi relado por Basso et al.(2016), Mota et al. (2018). Além disso, a elevada taxa de resistência às quinolonas, cefalosporinas, aminoglicosídeos, carbapenêmicos descrita neste estudo, é semelhante à descrita por Moolchandani et al. (2017), onde os não fermentadores isolados por ele apresentaram resistência às mesmas classes de antimicrobianos.
Quando se trata de fungemia, nota-se que o principal fungo associado é a Candida albicans(19, 21, 22,23).No Brasil,o levantamento de dados epidemiológicos de fungemias em comunidades e hospitais tornou-se cada vez mais freqüentes. Em seu estudo, Motta et al. (2010), relatou uma prevalência de 4% de fungemia em culturas de sangue com aproximadamente 86% de casos relacionados com espécies do gênero Candida sp. No entanto, de acordo com Silva et al. (2015), o cenário atual vem mostrando um aumento da incidência de candidemias causadas por espécies não albicans, principalmente por Candida parapsilosis.Tais estudos vêm de encontro com a presente pesquisa, uma vez que foi observado uma prevalência de cerca de 5% de formas fúngicas nas hemoculturas positivas analisadas, com uma maior frequência das espécies Candida parapsilosis e Candida albicans.
De acordo com Arias et al. (2010) o beta lactâmico mais eficaz contra infecções causadas por enterococos é a ampicilina, corroborando com o estudo, uma vez que esse antimicrobiano apresentou 89,5% de sensibilidade. Nota-se também, alta sensibilidade à tigeciclina, reafirmando a escolha desse fármaco como alternativa de tratamento. No entanto, Arias et al. alerta que a prescrição de tal medicamento deve ser feita com cautela visto que casos de resistência já foram relatados.
CONCLUSÃO
104Perante o exposto, notou-se que a prevalência de Staphylococcus coagulase negativa foi predominante, o qual serve como alerta para uma possível infecção causada por este micro-organismo, devendo ser analisado juntamente com a clínica do paciente, uma vez que, segundo a literatura atual, são responsáveis por contaminação de hemoculturas, sendo provenientes de erros de coleta. Para que se descubra qual a real etiologia dessas infecções, faz-se necessário enfatizar a correta assepsia das mãos dos profissionais a fim de manter a segurança do paciente e qualidade do resultado final da amostra.
105O estudo revelou relevante prevalência de enterobactérias fermentadoras e não fermentadoras com alto perfil de resistência à maioria dos antimicrobianos utilizados na clínica médica, o que incentiva o uso racional de medicamentos.
106Novas drogas e novas medidas de controle se fazem necessárias, tendo em vista que essa crescente resistência tornou-se um problema de saúde pública mundial.
REFERÊNCIAS
1. Agência Nacional de Vigilância Sanitária. Medidas de Prevenção de Infecção Relacionada à Assistência à Saúde. Brasília: Agência Nacional de Vigilância Sanitária, 2010.
2. Castro LL, Schutze M, Bucker DH, Vasconcellos LS. Prevalence of fungemia in a tertiary hospital: Analysis of the last decade. Rev Assoc Med Bras. 2016; 62(4): 315-319.
3. Araujo MRE. Hemocultura: recomendações de coleta, processamento e interpretação de resultados. J Infect Control. 2012; 1(1): 08-19.
4. Klingspor L, Ullberg M, Rydberg J, Kondori N, Serrander L, Swanberg J et al.Epidemiology of fungaemia in Sweden: A nationwide retrospective observational survey.Mycoses. 2018; 6: 777-785.
5. Ferreira LE, Dalposso K, Hackbarth BB, Gonçalves AR, Westphal GA, França PHC at al. Painel molecular para detecção de microrganismos associados à sepse. RevBras Ter Intensiva. 2011; 23(1): 36-40.
6. Sitnik R, Marra AR, Petroni RC, Ramos OPS, Martino MDV, Pasternak Jat al. Uso do SeptiFast para diagnóstico de sepse em doentes graves de um hospital brasileiro. Einstein. 2014; 12(2): 191-7.
7. Sociedade Brasileira de Patologia Clínica. Recomendações da Sociedade Brasileira de Patologia Clínica/Medicina Laboratorial (SBPC/ML):Boas práticas em microbiologia clínica. Barueri: Sociedade Brasileira de Patologia Clínica, 2015.
8. Siqueira JPZ, Almeida MAG. Molecular biology as a tool for fungal detection on blood: diagnostic aid and cost reduction. Arch. Helth. Sci. 2018; 25(3):41-45.
9. Giolo MP, Svidzinski TIE. Fisiopatogenia, epidemiologia e diagnóstico laboratorial da candidemia. J BrasPatolMed Lab. 2010; 46:225-34.
10. bioMérieux Brasil. Produtos e Serviços. Disponível em: URL: http://www.biomerieux.com.br/diagnostico-clinico/produtos-e-servicos. Acesso em 3 dezembro 2019.
11. Basso ME, Pulcinellii RSR, Aquino ARC, Santos KF. Prevalência de infecções bacterianas em pacientes internados em uma unidade de terapia intensiva (UTI). RevBras Anal Clin. 2016; 48(4): 383-88.
12. Mota FS, Oliveira HÁ, Souto RCF. Perfil e prevalência de resistência aos antimicrobianos de bactérias Gram-negativas isoladas de pacientes de uma unidade de terapia intensiva. Rev Bras Anal Clin. 2018; 50(3): 270-2.
13. Weiss SL, Fitzgerald JC, Pappachan J, Wheeler D, Jaramillo-Bustamante JC, Salloo A, Singhi SC, Erickson S, Roy JA, Bush JL, Nadkarni VM, Thomas NJ; Sepsis Prevalence, Outcomes, and Therapies (SPROUT) Study Investigators and Pediatric Acute Lung Injury and Sepsis Investigators (PALISI) Network. Global epidemiology of pediatric severe sepsis: the sepsis prevalence, outcomes, and therapies study. Am J RespirCrit Care Med. 2015; 191(10):1147-57. Erratum in: Am J RespirCrit Care Med. 2016; 193(2):223-4.
14. Chen XC, Yang YF, Wang R, Gou HF, Chen XZ. Epidemiology and microbiology of sepsis in mainland China in the first decade of the 21st century.Int J Infect Dis. 2015; 3: 9-14.
15. Park SY, Kwon KH, Chung JW, Huh HJ, Chae SL. Coagulase-negative staphylococcal bacteremia: risk factors for mortality and impact of initial appropriate antimicrobial therapy on outcome. Eur J ClinMicrobiolInfectDis. 2015; 34(7):1395-401.
16. Rodriguez F, Barrera L, De La Rosa G, Dennis R, Duenas C, Granados M, et al. The epidemiology of sepsis in Colombia: a prospective multicenter cohort study in tem university hospitals. Crit Care Med. 2011;39(7):1675-82.
17. Uc-Cachón AH, Osorno CG, Luna-Chi IG, Guillermo JGJ, Salinas GMM. High Prevalence of Antimicrobial Resistance AmongGram-Negative Isolated Bacilli in Intensive Care Units at a Tertiary-Care Hospital in Yucatán Mexico.Medicina.2019, 55, 588.
18. Morello LG, Dalla-Costa LM, Fontana RM, Netto ACSO, Petterle RR, Conte D, Pereira LA, Krieger MA, Raboni SM. Avaliação das características clínicas e epidemiológicas de pacientes com e sem sepse nas unidades de terapia intensiva de um hospital terciário. Einstein (São Paulo). 2019; 17(2): 1-8.
19. Anunnatsiri S, Chetchotisakd P, Mootsikapun P. Fungemia em pacientes não infectados pelo HIV: uma revisão de cinco anos. Int J InfectDis. 2009; 13 (1): 90-6.
20. Motta AL, Almeida DGM, Almeida Júnior JN, Burattini MN, Rossi, F. Candidemia epidemiologia e susceptibilidade perfil na maior complexo hospital universitário brasileiro. Braz J InfectDis. 2010; 14 (5): 441-8.
21. Colombo AL, Braga T, Silva LR, de Almeida Monfardini LP, Cunha AK, Rady P, et al. estudo prospectivo observacional de candidemia em São Paulo, Brasil: taxa de incidência, epidemiologia e preditores de mortalidade. Infect Controlo HospEpidemiol. 2007; 28 (5): 570-6.
22. Almirante B, D Rodriguez, Parque BJ, Cuenca-Estrella H, aplanam SOU, Almela H, et al .; Barcelona Candidemia Projeto StudyGroup. Epidemiologia e preditores de mortalidade em casos de infecção de corrente sanguínea Candida: resultados de vigilância de base populacional, Barcelona, Espanha, de 2002 a 2003. J Clin Microbiol. 2005; 43 (4): 1829-1835.
23. Costa SF, Marinho I, Araújo EA, Manrique AE, Medeiros EA, Levin AS. fungemianosocomial: um estudo prospectivo de 2 anos. J Hosp Infect. 2000; 45 (1): 69-72.
24. Myat TO, Hannaway RF, Zin KN, Htike WW, Win KK, Crump JA, Murdoch DR, Ussher JE. ESBL- and Carbapenemase-Producing Enterobacteriaceae in Patients with Bacteremia, Yangon, Myanmar, 2014.EmergingInfectiousDiseases. 2017; 23(5): 857-859.
25. Couto DO, Junior AAP, Farias JLM, Sales DB, Lima JPA, Rodrigues RS, Meneses FA. Associação entre sexo e mortalidade em pacientes com sepse: os hormônios sexuais influenciam o desfecho?. Revista brasileira de Terapia Intensiva. 2011; 23 (3): 297-303.
26. Wang HE, Donelly JP, Shapiro NI, Hohmann SF, Levitan EB. Hospital variations in severe sepsis mortality.Am J Med Qual. 2015; 30 (4): 328-336.
27. Sousa MA, Medeiros NM, Carneiro JR, Cardosos AM. Hemoculturas positivas de pacientes da unidade de terapia intensiva de um hospital escola de Goiânia, GO, entre 2010 e 2013. Estudos, Goiânia. 2014; 41(3): 627-635.
28. TakeshitaN, QuocAnh N, Phuong VT, Thuy, PP, Houng MTL, Takahashi, M and Ohmagari, N. Assessment of Bacteremia in a Large Tertiary Care Hospital in Northern Vietnam:a Single-Center Retrospective Surveillance Study. Jpn. J. Infect. Dis. 2019; 72: 118-120.
29. Silva MGC, Rodrigues GS, Gonçalves IL, Grazziotin NA. Distribuição de espécies de Candida e suscetibilidade ao fluconazol de isolados de hemocultivos em hospital regional de Passo Fundo, RS, Brasil. J. Bras. Patol. Med. Lab.2015; 51(3): 158-161.
30. Parajuli NP, Acharya SP, Mishra SK, Parajuli K. Basista Prasad Rijal and Bharat Mani PokhrelHigh burden of antimicrobial resistance among gram negative bacteria causing healthcare associated infections in a critical care unit of Nepal. Antimicrobial Resistance and Infection Control.2017; 6:67.
31. Moolchandani K, Sastry AS, Deepashree R, Sisltla S, Harish BM, Mandal J. Antimicrobial Resistance Surveillance among Intensive Care Units of a Tertiary Care Hospital in Southern India. Journal of Clinical and Diagnostic Research.2017; 11(2): 1-7.
32. Ruschel DB, Rodrigues AD, Formolo F. Perfil de resultados de hemoculturas positivas e fatores associados. RBAC. 2017; 49(2): 158-63.
33. Arias CA, Contreras GA, Murray BE. Management of multi drug-resistant enterococcal infections. Clin. Microbiol. Infect. 2010; 16: 555-562.