Número: 1.1 - 7 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos de Revisão
Investigação da resposta inflamatória promovida pelos poluentes ambientais: partículas eliminadas na exaustão do diesel (PED) e 1,2-Naftoquinona (1,2-NQ) em vias aéreas de ratos pré-tratados com capsaicina
Investigation of the inflammatory response promoted by environmental pollutants: diesel exhaust particles (DEP) and 1,2-Naphthoquinone (1,2-NQ) in capsaicin-pretreated rat airways
Aila Mirtes Teles1; Miguel Garray2; Soraia K. P. Costa3
Resumo
Objetivo: Condições inflamatória como a asma estão associadas com a exposição de poluentes ambientais incluindo partículas de exaustão do diesel (PED) e o composto químico (1,2-naftoquinona [1,2-NQ]). Neste estudo nós examinamos a relação entre a inflamação neurogênica e a exposição da PED mais 1,2-NQ nas vias aéreas de ratos. Método: Ratos wistar (250-280 g) anestesiados com cetamina mais xilazina foram utilizados. Depois de 3h os ratos foram sacrificados e os brônquios removidos. Os níveis de RNAm de TNF-alfa (receptores TNFR1 e TNFR2), NOSi e NF-capaB foram determinados utilizando a técnica de RT-PCR em tempo real. Resultados: Injeção intra-traqueal (i.tr.) de PED (1 mg/kg) mais 1,2-NQ (35 nmol/kg) causou aumento da expressão gênica de TNF-alfa (e seus receptores TNFR1 e TNFR2), NOSi mas não de NF-capaB (n=3-5) em vias aéreas de ratos pré-tratados com capsaicina. Conclusão: Este estudo demonstrou que a inativação de fibras C pela capsaicina exacerba a resposta inflamatória aguda causada pela exposição dos poluentes PED mais 1,2-NQ em tecidos bronquiopulmonares, como indicado pelo aumento de pró-inflamatórias citocinas (ex.: TNF-alfa [como provável conseqüência de infiltração maçiça de neutrófilos) e expressão de NOSi sugerindo um papel protetor das fibras C em vias aéreas de ratos.
Palavras-chave: inflamação neurogênica, poluentes do ar, ratos, sistema respiratório.
INTRODUÇÃO
O material particulado (MP) emitida pela exaustão do diesel (PED) compreende uma mistura de gases, vapores, compostos orgânicos e partículas finas liberadas da engenharia do veículo. Considerada uma das principais vilãs no desencadeamento de reações inflamatórias e alérgicas, visto que suas partículas finas (PM<2,5 µm) penetram mais facilmente pelas vias aéreas, podendo causar complicações pulmonares(1). Evidências bioquímicas demonstram ainda que moléculas químicas tóxicas tais como quinonas (1,2-NQ) incorporam-se à superfície da PED, tornando-as mais tóxicas (2). Considerado uma barreira física e metabolicamente ativa, o epitélio pulmonar contribui para a manutenção da homeostase das vias aéreas. Segundo Davies et al.,(3) a inflamação e o remodelamento das vias aéreas, parecem relacionar-se à susceptibilidade do epitélio brônquico do paciente a agentes inalados do meio ambiente. As vias aéreas contêm inervação abundante de fibras aferentes sensoriais(4), a estimulação destas fibras por mediadores químicos é modulada por receptores específicos, dentre esses, destacam-se os receptor vanilóide-1 (TRPV1), sabidamente ativados pela capsaicina, ingrediente pungente extraído de pimentas vermelhas do gênero Capsicum(5). A administração da capsaicina a ratos recém-nascidos (2 a 10 dias de idade), na dose de 50 mg/kg, promove a máxima degeneração de fibras aferentes sensoriais não mielinizadas com conseqüente comprometimento neuroquímico, histoquímico e funcional (6). Conexões existem entre poluentes e as disfunções vasculares (ex.: inflamação) via mecanismos modulados por estresse oxidativo e NO(1), citocinas como TNF-α, o qual tem seus efeitos biológicos mediados pela interação com seus receptores de superfície celular: TNFR-I e TNFR-II (7); ativação do fator de transcrição NF-κB em células epiteliais do trato respiratório (8), porém pouco se sabe sobre a associação de poluentes ambientais e a participação de componentes neuro-inflamatórios (ex.: neuropeptídeos).
2. OBJETIVO
Estudar a relação da inflamação promovida pelos poluentes ambientais: PED e 1,2-NQ com mecanismos neurogênicos em brônquio principal de rato.
2 MÉTODOS
2.1 Animais
O projeto foi desenvolvido de acordo com as normas regidas pelo Comitê de Ética Animal do Instituto de Ciências Biomédicas da Universidade de São Paulo. Ratos Wistar, de ambos os sexos (250 - 350g) e em determinados protocolos, ratos Wistar, recém-nascidos (2 a 10 dias de idade), tratados com capsaicina, na dose de 50 mg/kg, foram utilizados. Os animais utilizados foram anestesiados, pela via intraperitonial (i.p.), com a mistura de cetamina (80 mg/kg) e xilazina (16 mg/kg). Após indução da anestesia, receberam injeção intratraqueal (i.tr.) dos agentes testes sendo sacrificados após 3 horas.
2.2 Quantificação da expressão gênica (TNF-α, TNFR1, TNFR2, NF-κB, NOSi) por PCR em tempo real
Os animais foram tratados com os poluentes e após 3 horas os brônquios principais foram submetido à análise da expressão gênica da citocina TNF-α e seus receptores: R1 e R2, bem como do NF-κB e NOSi pelo ensaio de PCR. A extração do RNA total foi realizada pelo método do Trizol. O PCR em tempo real tem como base a presença do fluoróforo, presente no tampão do PCR, o qual libera a fluorescência que é proporcional ao número de cópias do DNA.
2.3 Análise estatística
Os dados foram expressos como médias ± EPM de valores absolutos. Os mesmos foram submetidos à análise de variância de uma única via (ANOVA), seguida pelo teste modificado de Bonferroni's. As diferenças entre as médias foram avaliadas com o auxílio do programa estatístico (software Prism 4.0). Valores de p<0,05 foram considerados significantes.
3. RESULTADOS
3.1 Quantificação da expressão gênica do TNF-α, TNFR1, TNFR2, NF-κB e NOSi por PCR em tempo real em brônquio principal de rato exposto aos poluentes
A expressão gênica da citocina TNF-α e dos seus receptores TNFR1 e TNFR2 foi aumentada no brônquio de ratos tratados isoladamente com 1,2-NQ comparado com o respectivo veículo (Figura 1A-C). No brônquio de ratos tratados com as PED, a expressão do receptor TNFR1, mas não do TNF-α e receptor TNFR2, foi alterada (P<0,05) quando comparada com animais que receberam o veículo (Figura 1A-C). No grupo de animais que recebeu a mistura dos poluentes (DEP+1,2-NQ), observou-se um aumento significativo apenas na expressão do receptor TNFR1 (P<0,001) comparado com o grupo veículo.
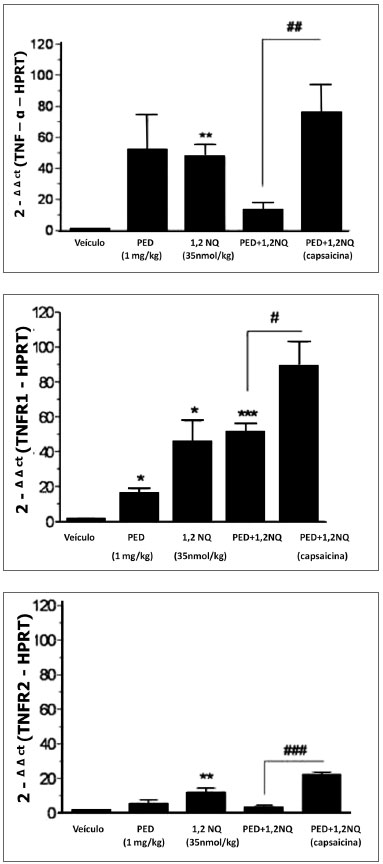
Figura 1 A,B,C. Análise da expressão do gene da citocina TNF-α (painel 1A) e seus receptores TNFR1 (painel 1B), TNFR2 (painel 1C) em brônquio principal de ratos. Os dados estão expressos como a média ± E.P.M. para n=3-5 animais. *P<0,05, **P<0,01 e ***P<0,001 versus veículo. #P<0,05, ##P<0,01 e ###P<0,001 versus grupo tratado com a mistura dos poluentes que receberam capsacina, quando neonatos.
No grupo de animais pré-tratado com capsaicina que recebeu a mistura dos poluentes foi observado um aumento significativo das expressões gênicas do TNF-α (P<0,01) e seus receptores TNFR1 (P<0,05) e TNFR2 (P<0,001) comparado com o grupo de animais que receberam apenas a mistura dos poluentes (Figura 1A-C).
Não foram observados alterações significativas na expressão gênica do NF-kB nos diversos grupos (Figura 2).
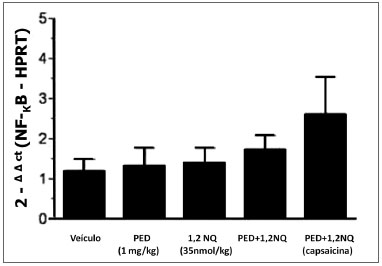
Figura 2. Análise da expressão do gene do fator de transcrição NF-kB em brônquio principal de ratos. Os dados estão expressos como a média ± E.P.M. para n=3-5 animais.
A mistura de poluentes não causou alteração significativa na expressão da NOSi, exceto com as PED isoladas (P<0,05), em relação ao grupo veículo. Já nos animais tratados com capsaicina, a administração da mistura de poluentes causou um aumento marcante na expressão de NOSi comparado aos animais expostos aos mesmos poluentes, não tratados com capsaicina (P<0,01; Figura3).
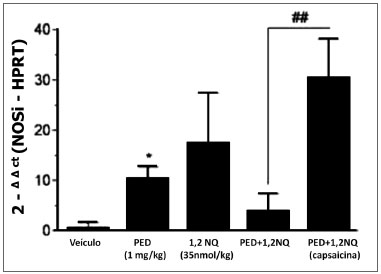
Figura 3. Análise da expressão do gene da NOSi em brônquio principal de ratos tratados i.tr. com os poluentes e seus veículos (após 3 h). Os dados estão expressos como a média ± E.P.M. para n=3-5 animais. *P<0,05 versus veículo. ##P<0,01 versus grupo tratado com a mistura dos poluentes que receberam capsacina, quando neonatos.
4. DISCUSSÃO
Considerada um dos principais constituintes do MP ambiental nas aéreas urbanas, as PED têm sido implicadas no desencadeamento de doenças inflamatórias das vias aéreas (9). Além disso, compostos químicos reativos tais como quinonas e seus produtos de redução (ex. hidroquinona, semiquinonas), encontrados na natureza ou em MP suspenso no ar (2), são de particular interesse toxicológico, pois produzem, via mecanismos complexos, uma variedade de efeitos nocivos sobre a saúde da população. Dentre estes efeitos, destacam-se: a capacidade de gerar espécies reativas de oxigênio, promover ligações covalentes com macromoléculas dos tecidos (10) que levam à citotoxicidade e morte celular (2) e, ainda, interferem com reações enzimáticas, causando imunotoxicidade e carcinogêse (11).
O processo inflamatório de vias aéreas está associado à maior produção de citocinas pró-inflamatórias por células epiteliais (12), macrófagos (13), mastócitos (14) e eosinófilos (15). As citocinas também apresentam papel relevante na ativação celular, proliferação, diferenciação celular, adesão, migração e síntese de proteínas da fase aguda. Além disso, estudos clínicos e experimentais apontam as citocinas como alvo em doenças pulmonares obstrutivas crônicas (16). Dentre as citocinas envolvidas nas reações inflamatórias das vias aéreas, o TNF-α possui um papel de destaque, pois, além de recrutar leucócitos nas vias aéreas, aumenta a aderência de neutrófilos e monócitos à matriz celular, estimula a proliferação de fibroblastos e a produção de outras citocinas inflamatórias (17).
É interessante ressaltar que a citocina pró-inflamatória TNF-α possui ação estimulantes sobre fatores nucleares, incluindo o fator NF-kB (18). Apesar dos níveis elevados desta citocina nos homogenatos de brônquios de ratos expostos aos poluentes, a análise de PCR em tempo real não detectou aumento significativo na concentração da proteína NF-kB nos brônquios dos animais, indicando que no tempo investigado, a concentração formada do TNF-α não interferiu na geração do fator NF-kB.
Além das citocinas, o envolvimento de espécies reativas (NO) na resposta inflamatória tem sido amplamente demonstrado na literatura. Este produto foi também encontrado na poluição atmosférica e na fumaça do cigarro (19). Em geral, a citotoxidade do NO estar relacionada à ação desta molécula com outros compostos liberados durante a inflamação, os ensaios de PCR deste estudo mostraram aumento significativo na expressão do gene da NOSi em brônquio principal de ratos tratados i.tr. com as PED e com a mistura dos poluentes, pré-tratados com capsaicina mas não nos animais tratados com a 1,2-NQ ou a mistura destes, que não receberam capsaicina.
As vias aéreas são densamente inervadas por fibras nervosas sensoriais (20) que, mediante estímulos endógenos (ex.: mediadores químicos inflamatórios) ou exógenos (ex.: capsaicina, microorganismos) adequados, culminam na liberação de neuropeptídeos, capazes de iniciar respostas/mecanismos de defesa tais como, tosse, vasodilatação local, broncoconstrição e secreção de muco. Estes podem ser definidos classicamente como inflamação neurogênica. Os resultados inflamatórios obtidos em ratos tratados com capsaicina (depletados de neuropeptídios) foi potencializado quando comparado com animais saudáveis. Embora intrigante, o presente achado vem ao encontro de outros dados de literatura, os quais sugerem que a degeneração das fibras sensoriais (tipo C), pela capsaicina, exacerbou a resposta inflamatória em vários modelos experimentais.
Dentre os estudos, Medeiros et al. (21) demonstraram que o tratamento neonatal de ratos com capsaicina aumentou a neutrofilia evocada por OVA no lavado broncoalveolar e na cavidade pleural destes. Este mesmo tratamento promoveu hiperreatividade nas vias aéreas de ratos (21). Em cobaias, o tratamento com capsaicina contribuiu para um maior aumento na reatividade brônquica em resposta à fumaça do cigarro (22).
No conjunto, os dados obtidos neste estudo juntamente com os descritos na literatura, indicam que o comprometimento na biossíntese de neuropeptídeos, principalmente as taquicininas, constitui um aspecto bastante relevante para a regulação positiva da neutropoiese. É provável que a resposta inflamatória exacerbada induzida pelas PED e 1,2-NQ no brônquio de animais tratados com capsaicina seja, em parte, decorrente do aumento na gênese de citocinas pró-inflamatórias. O aumento significativo das expressões gênicas do TNF-α e seus receptores (TNFR1 e TNFR2) frente aos poluentes no brônquio de ratos pré-tratados com capsaicina em relação aos animais saudáveis reforça esta hipótese.
Adicionalmente, duas outras hipóteses podem ser discutidas para explicar melhor o maior influxo de neutrófilos frente aos poluentes em animais depletados de neuropeptídeos: a primeira, baseada em evidências de Franco et al.,(23) os quais sugerem que a perda permanente das fibras C e a conseqüente supressão da produção de neuropeptídeos pelo tratamento de ratos neonatos com a capsaicina, leva ao aumento da expressão/regulação de mastócitos pulmonares residentes. Desta forma, podemos postular que, se os mastócitos estão em maior quantidade no parênquima pulmonar de ratos tratados com capsaicina; estes, quando estimulados pela mistura de poluentes, resultarão numa maior produção de citocinas e conseqüentemente em maior influxo de leucócitos local podendo concluir que o influxo de neutrófilos induzido pelos poluentes em brônquios de ratos depletados de neuropeptídeos se deu em conseqüência do aumento da regulação gênica de algumas citocinas por mastócitos.
Em conclusão, os resultados apresentados neste estudo nos permitem sugerir que o aumento na produção e/ou liberação endógena de mediadores inflamatórios como as citocinas, modula grandemente a resposta inflamatória induzida pelos poluentes ambientais PED e 1,2-NQ, cujo processo autofarmacológico é intensificado nos animais destituídos de fibras nervosas sensoriais. Isto se deve, em parte, ao fato de que nestes animais, a ausência de neuropeptídeos (possivelmente as taquicininas) resultou em aumento da atividade funcional dos macrófagos juntamente com a produção de citocinas pró-inflamatórias por estas células e, possivelmente, por mastócitos pulmonares residentes. Estas evidências contribuem com um crescente argumento de que a perda da sinalização aferente taquicininérgica leva à piora do quadro inflamatório induzido por substâncias irritantes, incluindo os poluentes PED e 1,2-NQ.
5. AGRADECIMENTOS
Os poluentes foram gentilmente cedidos pelo Prof. Dr. Yoshito Kumagai (Universidade de Tsukuba, Japão) e os ratos Wistar tratados com capsaicina pelo Prof. Dr. Edson Antunes (Universidade de Campinas). Agradecemos ainda o apoio técnico da Sra. Maria Alice Barreto.
6. REFERÊNCIAS
1. Donaldson K. The biological effects of coarse and fine particulate matter. Occup Environ Med 2003 May;60(5):313-4.
2. Cho AK, Schimitz DA, You Y, Rodriquez CE, Distefano E, Kumagai Y, et al. Detemination of four quinones in Diesel exaust particles, SRM1649A and athmosferic 2.5. Aerosol Sci Technol 2004;38:1-14.
3. Davies DE, Holgate ST. Asthma: the importance of epithelial mesenchymal communication in pathogenesis. Inflammation and the airway epithelium in asthma. Int J Biochem Cell Biol 2002 Dec;34(12):1520-6.
4. Joos GF, Germonpre PR, Pauwels RA. Role of tachykinins in asthma. Allergy 2000 Apr;55(4):321-37.
5. Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 1997 Oct 23;389(6653):816-24.
6. Jancso N, Jancso-Gabor A, Szolcsanyi J. Direct evidence for neurogenic inflammation and its prevention by denervation and by pretreatment with capsaicin. Br J Pharmacol Chemother 1967 Sep;31(1):138-51.
7. Wallach D, Varfolomeev EE, Malinin NL, Goltsev YV, Kovalenko AV, Boldin MP. Tumor necrosis factor receptor and Fas signaling mechanisms. Annu Rev Immunol 1999;17:331-67.
8. Dagher Z, Garcon G, Billet S, Verdin A, Ledoux F, Courcot D, et al. Role of nuclear factor-kappa B activation in the adverse effects induced by air pollution particulate matter (PM2.5) in human epithelial lung cells (L132) in culture. J Appl Toxicol 2007 May-Jun;27(3):284-90.
9. Nemmar A, Al-Maskari S, Ali BH, Al-Amri IS. Cardiovascular and lung inflammatory effects induced by systemically administered diesel exhaust particles in rats. Am J Physiol Lung Cell Mol Physiol 2007 Mar;292(3):L664-70.
10. Cadenas E, Hochstein P, Ernster L. Pro- and antioxidant functions of quinones and quinone reductases in mammalian cells. Adv Enzymol Relat Areas Mol Biol 1992;65:97-146.
11. Monks TJ, Jones DC. The metabolism and toxicity of quinones, quinonimines, quinone methides, and quinone-thioethers. Curr Drug Metab 2002 Aug;3(4):425-38.
12. Ackerman V, Marini M, Vittori E, Bellini A, Vassali G, Mattoli S. Detection of cytokines and their cell sources in bronchial biopsy specimens from asthmatic patients. Relationship to atopic status, symptoms, and level of airway hyperresponsiveness. Chest 1994 Mar;105(3):687-96.
13. Gosset P, Tsicopoulos A, Wallaert B, Joseph M, Capron A, Tonnel AB. Tumor necrosis factor alpha and interleukin-6 production by human mononuclear phagocytes from allergic asthmatics after IgE-dependent stimulation. Am Rev Respir Dis 1992 Sep;146(3):768-74.
14. Gordon JR, Burd PR, Galli SJ. Mast cells as a source of multifunctional cytokines. Immunol Today 1990 Dec;11(12):458-64.
15. Shah A, Church MK, Holgate ST. Tumour necrosis factor alpha: a potential mediator of asthma. Clin Exp Allergy 1995 Nov;25(11):1038-44.
16. Chung KF. Cytokines as targets in chronic obstructive pulmonary disease. Curr Drug Targets 2006 Jun;7(6):675-81.
17. Thommesen L, Sjursen W, Gasvik K, Hanssen W, Brekke OL, Skattebol L, et al. Selective inhibitors of cytosolic or secretory phospholipase A2 block TNF-induced activation of transcription factor nuclear factor-kappa B and expression of ICAM-1. J Immunol 1998 Oct 1;161(7):3421-30.
18. Solt LA, Madge LA, Orange JS, May MJ. Interleukin-1-induced NF-kappaB activation is NEMO-dependent but does not require IKKbeta. J Biol Chem 2007 Mar 23;282(12):8724-33.
19. Borland C, Higenbottam T. Nitric oxide yields of contemporary UK, US and French cigarettes. Int J Epidemiol 1987 Mar;16(1):31-4.
20. Spina D, Page CP. Pharmacology of airway irritability. Curr Opin Pharmacol 2002 Jun;2(3):264-72.
21. Medeiros MV, De Luca IM, Bricola AA, Zanesco A, De Nucci G, Antunes E. Enhanced airways responsiveness in rats depleted of sensory neuropeptides by neonatal capsaicin treatment. Neurosci Lett 2003 May 1;341(2):103-6.
22. Mutoh T, Joad JP, Bonham AC. Chronic passive cigarette smoke exposure augments bronchopulmonary C-fibre inputs to nucleus tractus solitarii neurones and reflex output in young guinea-pigs. J Physiol2000 Feb 15;523 Pt 1:223-33.
23. Franco-Penteado CF, De Souza IA, Camargo EA, Teixeira SA, Muscara MN, De Nucci G, et al. Mechanisms involved in the enhancement of allergic airways neutrophil influx by permanent C-fiber degeneration in rats. J Pharmacol Exp Ther 2005 Apr;313(1):440-8.
1. Ph.D (Pesquisadora).
2. Ph.D (Professor Doutor na Escola de Artes, Ciências e Humanidades (EACH) da Universidade de São Paulo).
3. Livre Docência (Professora associada do Departamento de Farmacologia do Instituto de Ciências Biomédicas da Universidade de São Paulo).
Correspondência:
Teles AM
Rua Dr. Pena Forte Mendes, 86 Apart. 13. Bela Vista
São Paulo-SP Cep. 01308-010
Tel: (11) 3214-0597
E-mail address: [email protected]
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da Rev Bras Cien Med Saúde em 1 de março de 2009 . Cod. 11.
Artigo aceito em 2 de outubro de 2009.
CNPq; FAPESP



